針對SWI/SNF復合物亞基的癌癥治療新策略

染色質重塑是基因表達動態調控的重要機制之一,主要由不同的蛋白質/蛋白質復合物完成。SWI/SNF復合物是其中之一,轉錄調控因子將SWI/SNF復合物募集到DNA區域,沿DNA移動并通過變構核小體修改DNA的可訪問性或可及性(重塑染色質),通過轉錄調節因子與暴露的DNA的結合實現基因表達調控(抑制或者激活)。SWI/SNF亞基基因在20%以上的惡性腫瘤中發生突變,其亞基的突變會給癌癥帶來脆弱性,為新藥研發提供方向[1]。
什么是SWI/SNF復合物?
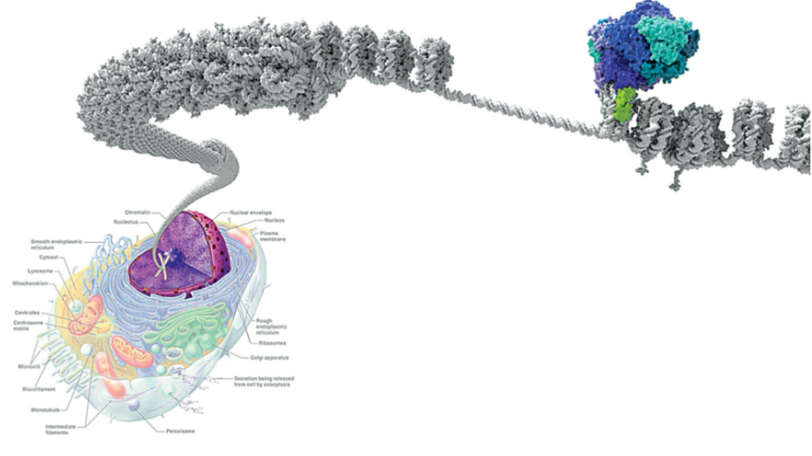
DNA 包裹在組蛋白周圍形成核小體,這些核小體又盤繞成致密的染色質(圖1灰色)。染色質處于緊縮狀態下無法讀取DNA信息。因此,一種精細的細胞機制與轉錄因子協同工作以動員核小體從而控制基因表達,這一過程稱為染色質重塑。染色質重塑復合物SWI/SNF也稱為 BRG1/BRM (BAF) 復合物(圖1藍色)通過水解ATP獲得能量移動核小體并去除組蛋白核心解開DNA,開放狀態下DNA能被轉錄。SWI/SNF復合物不僅與啟動子結合,還與其他調控區域(如增強子和DNA復制起始區)緊密結合。此外,SWI/SNF可結合/共沉淀許多蛋白質,在細胞周期等過程中發揮作用。這表明SWI/SNF復合物的功能比單純的轉錄調控更為廣泛[2]。
SWI/SNF復合物亞基組成
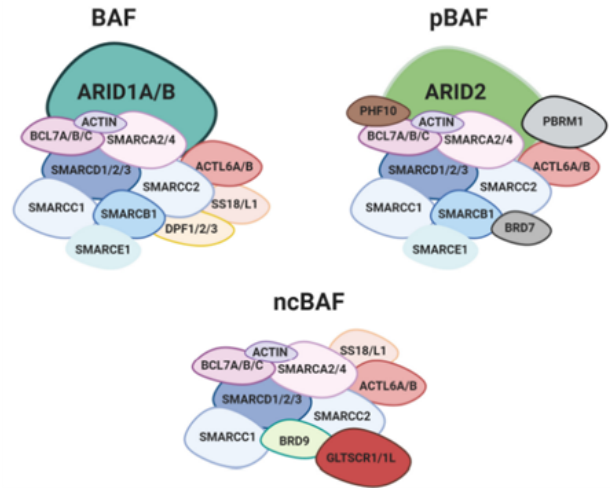
SWI/SNF 復合物是復雜的大分子組裝體,由許多不同和可變的亞基組成。SWI/SNF復合物分成典型BAF復合物(cBAF)、多溴相關BAF復合物(pBAF)、一種新發現的復合物(ncBAF)三個大類,每一類具有不同的亞單位結構和功能,三種類型的BAF都包含核心亞基SMARCC1、SMARCC2和ATP酶(SMARCA4或SMARCA2),協同調節染色質的狀態。此外三種類型既有共享亞基也包括特異性亞基,其中ncBAF包含特異性亞基(GLTSCR1 / 1L和BRD9)[3]。SWI/SNF 復合物中任何一個亞基的缺陷都可能會產生嚴重后果。在本文中我們將重點關注 SWI/SNF復合物亞基突變致癌的作用。
SWI/SNF復合物亞基突變與腫瘤
癌癥基因測序揭示,大約25%的癌癥存在一個或多個 SWI/SNF亞基基因異常,總共至少有九種不同的SWI/SNF亞基被鑒定為在各種癌癥中反復發生突變。那SWI/SNF復合物亞基突變導致癌癥發展的機制是什么?影響 SWI/SNF 亞基功能的突變是否會給這些癌癥帶來脆弱性?接下來將列舉幾種主要的亞基突變與癌癥發生機制,以及相應的抗腫瘤治療策略。
靶向SWI/SNF復合物ARID1A和 ARID1B
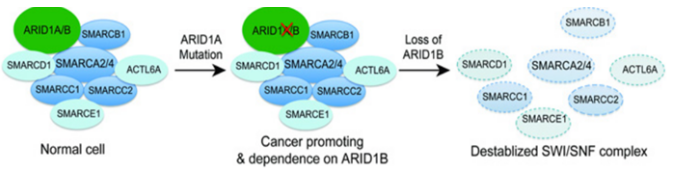
目前研究發現編碼 SWI/SNF 亞基的基因的突變通常會對編碼其他 SWI/SNF 亞基的基因產生特定的依賴性,亞基突變不會完全喪失SWI/SNF 功能,而是依賴于SWI/SNF 復合物同源亞基的活性導致異常細胞功能。ARID1A 突變細胞系特別依賴于其旁系同源物ARID1B,這是最早闡明旁系同源物依賴性的研究之一。ARID1A被發現在近 50% 的卵巢透明細胞癌 (OCCC) 和卵巢子宮內膜樣癌 (OEC) 中發生突變。SWI/SNF 復合物中的 ARID1B是ARID1A 互斥同源物,在腫瘤中ARID1A的突變導致SWI/SNF 復合物產生了對 ARID1B 的依賴,研究發現在ARID1A突變細胞中抑制ARID1B 會使 SWI/SNF 復合物不穩定并影響細胞增殖[3]。
SMARCA4和SMARCA2同樣,已顯示SMARCA4突變細胞系對其旁系同源物SMARCA2的依賴性。SMARCA2和SMARCA4為SWI/SNF的ATP水解酶,負責染色質的重塑和修復,SMARCA4是繼ARID1A之后惡性腫瘤中第二頻繁突變的SWI/SNF基因,其作用比SMARCA2更重要。SMARCA4在很多缺乏可靶向癌基因的癌癥中突變,包括10-20%的非小細胞肺癌、100%的小細胞卵巢癌、28%的皮膚癌、16%的膠質瘤,以及14%的結腸癌。SMARCA4突變癌細胞更依賴SMARCA2,因此選擇性SMARCA2抑制劑或降解劑可以誘導SMARCA4缺陷型癌細胞死亡。這些發現表明了一種機制,即 SWI/SNF 亞基的丟失由旁系同源物部分補償,使旁系同源物具有一種特殊的脆弱性[2]。

SMARCB1和BRD9這種復雜的內部依賴性不限于旁系同源亞基,目前已顯示SMARCB1突變細胞系對非旁系 SWI/SNF 亞基 BRD9的依賴性增加。滑膜肉瘤 (SS) 是一種罕見的間葉來源惡性腫瘤,約占所有軟組織肉瘤 (STS) 的8%至10%,SS幾乎可以發生在任何部位,SS具有高轉移性。融合蛋白SS18-SSX在100%的滑膜肉瘤病例中發現,SS18-SSX融合蛋白取代SWI/SNF中正常的SS18亞基。可能由于融合蛋白體積較大,SMARCB1亞基從滑膜肉瘤SWI/SNF復合物中被置換,SMARCB1被排出及降解導致功能喪失。由于破壞兩個含有 SMARCB1 的亞基的SWI/SNF 復合物類型(cBAF 和 pBAF),進而增加對第三個亞家族(ncBAF)的依賴。研究發現ncBAF的特異性BRD9亞基的化學和生物消耗迅速減弱SS細胞增殖,這些發現揭示了 ncBAF 復合物獨特的染色質靶向和功能,并提出了新的癌癥特異性治療靶點。
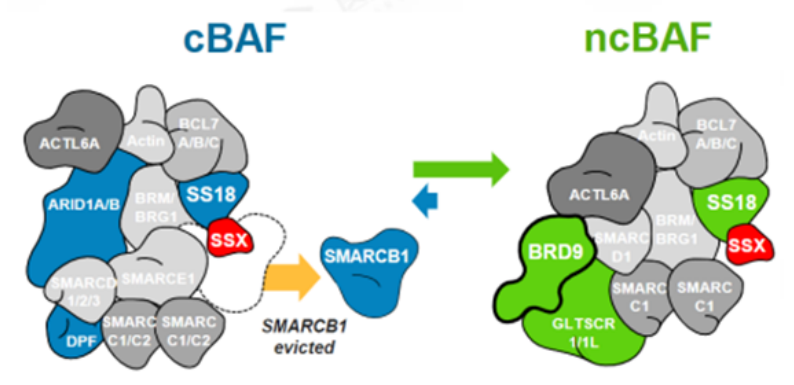
圖5.SS18-SSX融合蛋白替換SMARCB1示意圖(圖片來源C4 Therapeutics官網)靶向非SWI/SNF 復合物SMARCB1和EZH2研究表明 SWI/SNF 復合物和與其他染色質修飾物家族Polycomb 阻遏物復合物(PRCs)具有相反的基因調節功能。在正常細胞內,PRC2通過其酶亞基(EZH2) 催化維持H3K27三甲基化 (H3K27me3) 標記,促進染色質凝集,從而抑制轉錄。SWI/SNF 復合物定位于H3K27ac位點,與轉錄因子合作建立開放的染色質狀態,促進轉錄。SWI/SNF復合物對PRC2(含有EHZ2亞基)起到抑制作用,促進PRC2的靶基因的表達,促進轉錄的進行[2]。
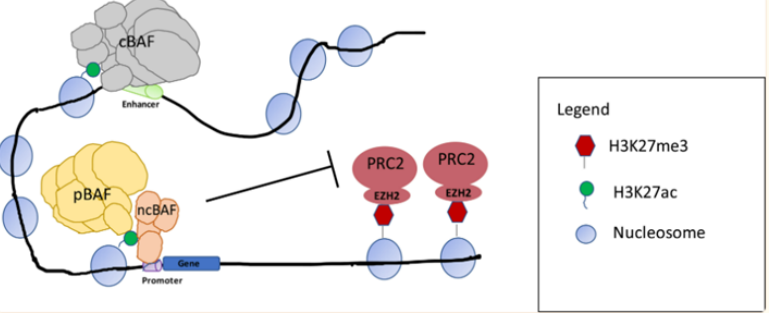
復合物與PCR2定位[2]SMARCB1(INI1)的缺失在90%以上的上皮樣肉瘤(ES)病人中發生,且成為ES的一個典型的診斷特點。在ES中SMARCB1發生突變或缺失時導致EZH2活性增強,H3K27me3水平升高,造成組蛋白和DNA緊密結合,很多抑癌基因的表達受到抑制,而hedgehog、MYC等信號通路基因等上調,促使細胞增殖,形成腫瘤。研究發現在ES中,使用EZH2抑制劑特異性作用于靶點EZH2時,降低EZH2活性,最終染色質的“捆綁和束縛”得到釋放,基因得以正常表達,達到殺死腫瘤的效果。EZH2抑制劑Tazemetostat在2020年1月獲得FDA批準,用于治療16歲及以上、不符合完全切除條件的轉移性或局部晚期ES兒童和成人患者。
ARID1A與ATR研究發現SWI/SNF 復合物還與 DNA 損傷修復 (DDR)的幾種機制有關。不同的 SWI/SNF 家族成員已被證明在 DDR 中具有不同的作用,從重塑DNA 損傷位點周圍的染色質結構到直接招募 DDR所需的蛋白質。cBAF和pBAF復合物涉及非同源末端連接 (NHEJ) 和同源重組 (HR)修復過程。ARID1A 通過與 ATR 的相互作用被招募到DNA雙鏈斷裂(DSB)處,為了應對 DNA 損傷,ARID1A 促進 DNA DSB 末端加工以生成 RPA 包被的單鏈 DNA (ssDNA),并維持 ATR 激活以響應 DSB。ARID1A 的缺失導致檢查點激活和DSB 修復受損,這使細胞對 DSB 誘導治療敏感,例如PARP抑制劑,ATR抑制劑[6]。臨床前數據證明了 ARID1A 缺失與 VX-970(ATR 的抑制劑)之間的協同作用,以及 PARP 抑制劑與放射治療在 ARID1A 突變腫瘤中的功效。PARP 或 ATR 抑制劑目前正在幾項ARID1A 突變癌癥患者的試驗中被評估[2]。
2022AACR公布的SWI/SNF復合物亞基突變治療新策略
BRD9靶向抑制劑
CFT8634根據上文的機制在滑膜肉瘤病例發現100%SS18-SSX融合蛋白,針對SS18-SSX融合蛋白本身很難開發藥物,根據SS18-SSX融合導致SMARCB1脫離cBAF、pBAF復合物,使得染色質重塑復合物更依賴ncBAF, 那么靶向ncBAF復合物的特異性亞基BRD9就有可能抑制SMARCB1缺失腫瘤[5]。C4 Therapeutics公司的CFT8634是一款雙特異性分子,它能夠將BRD9和E3泛素連接酶CRBN連接在一起,在BRD9蛋白上添加泛素修飾,導致BRD9的特異性降解。傳統的小分子抑制劑僅僅限制了乙酰賴氨酸溴化酶的閱讀功能,而降解技術能夠最大化破壞ncBAF復合物的致癌活性。在滑膜肉瘤的臨床前模型中,CFT8634表現出持續降低腫瘤體積的效果。這款在研療法已經獲得美國FDA授予治療滑膜肉瘤的孤兒藥資格,其IND申請在今年2月底獲得許可,預計在今年上半年開始針對滑膜肉瘤患者的I期臨床試驗。
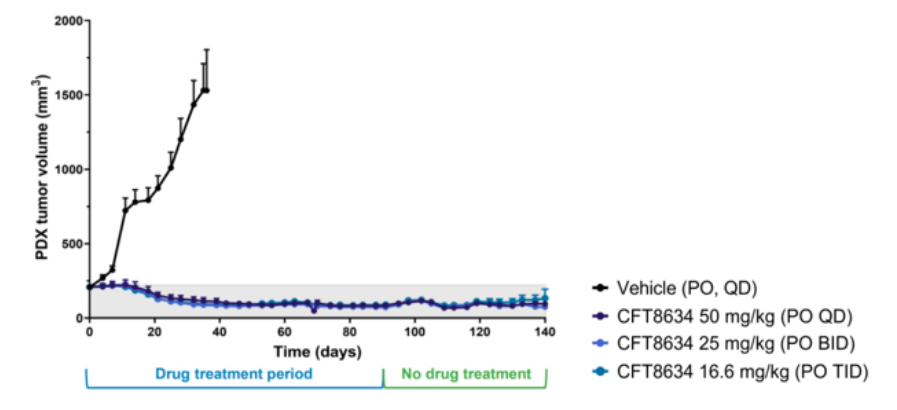
圖7.CFT8634臨床前腫瘤抑制效果(圖片來源:C4 Therapeutics官網)Foghorn公司研發的FHD-609也是BRD9的選擇性蛋白質降解劑,在臨床前研究中,FHD-609已被證明可以選擇性地降解BRD9,利用與SS18-SSX易位的合成致死關系殺死癌細胞,目前FHD-609是第一個進入臨床的BRD9降解劑。
SMARCA2選擇性抑制劑PRT3789SMARCA2和SMARCA4 都是SWI/SNF復合物的ATP酶,負責染色質的重塑和修復。SMARCA4突變癌細胞依賴旁系SMARCA2,因此選擇性SMARCA2抑制劑或降解劑可以誘導SMARCA4缺陷型癌細胞死亡。在SMARCA4突變肺癌細胞系中的全基因組CRISPR篩選表明,MCL1的丟失可以使SMARCA4突變肺癌細胞對SMARCA2降解敏感,Prelude Therapeutics公司的SMARCA2降解劑 PRT3789 聯用MCL1抑制劑PRT1419在SMARCA4突變肺癌模型中產生協同作用,并且不影響SMARCA4野生型細胞。PRT3789對SMARCA2選擇性強(超SMARCA4 20倍),體內外模型耐受良好,Prelude預計2022年年底申報臨床。
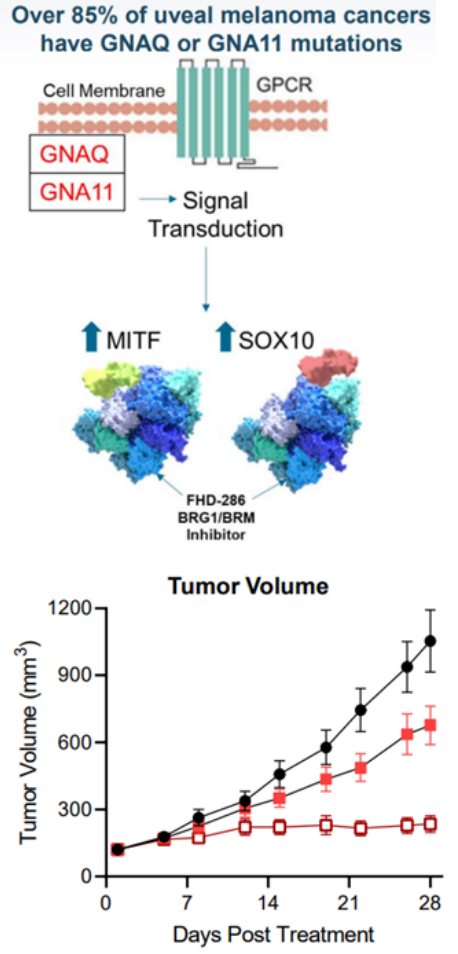
SMARCA2/SMARCA4雙抑制劑FHD-286Foghorn今年AACR披露首個進入臨床的SMARCA2/SMARCA4雙抑制劑 FHD-286臨床前數據。FHD-286是Foghorn公司一款BAF復合物口服抑制劑,用于治療AML和葡萄膜黑色素瘤(UM)。FHD-286通過抑制BAF復合體中的ATP酶成分SMARCA4和SMARCA2,抑制BAF的功能。FHD-286抑制SMARCA2/SMARCA4影響SPI1轉錄水平及其下游轉錄程序,從而影響細胞增殖和細胞存活。SPI1是一種 ETS 家族轉錄因子,在造血發育和分化中起關鍵作用,SPI1表達調節與急性髓性白血病 (AML) 的腫瘤發生有關。臨床前證據顯示FHD-286在AML患者樣品中廣泛有效,低納摩爾劑量具有促進細胞分化的作用,細胞殺傷作用與標準療法相當,劑量依賴性抑制腫瘤生長(圖8)。目前FHD-286已開展針對AML/MDS的I期臨床試驗。

在85%葡萄膜黑色素瘤(UM)中存在GNAQ / GNA11突變,其轉錄因子MITF和SOX10過表達并與BAF復合物過度相互作用,FHD-286抑制SMARCA2/SMARCA4,導致SOX10 和 MITF 轉錄因子結合位點的可及性喪失,抑制依賴SOX10和MITF的基因(GNAQ / GNA11)表達,臨床前數據顯示FHD-286劑量依賴性抑制腫瘤生長(圖9)。目前FHD-286已開展針對UM的I期臨床試驗。
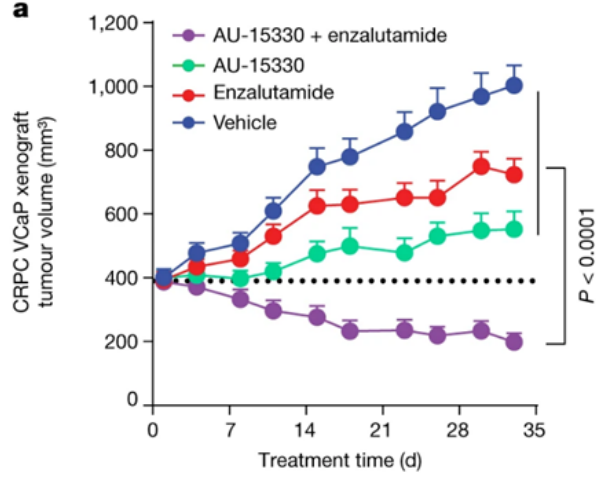
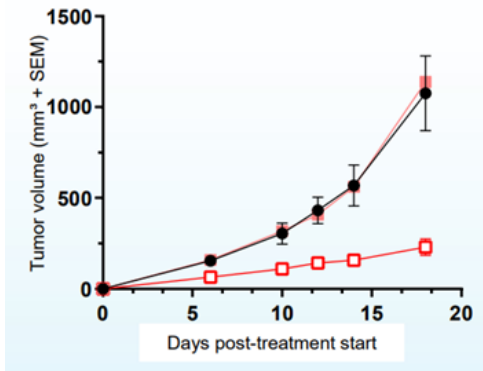
AU-15330SWI/SNF復合物的組分在一些癌癥中發生了突變,但在前列腺癌中很少發生。相比于SWI/SNF復合物的亞基發生突變的癌癥,由雄激素受體(AR)或FOXA1驅動的前列腺癌對SWI/SNF降解劑更敏感。AU-15330是Aurigene 公司的一款SWI/SNF ATP酶亞基(SMARCA2和SMARCA4)的蛋白水解靶向嵌合體降解劑。主要的作用機制是降解SMARCA2和SMARCA4,阻止對染色質的訪問,壓縮AR、FOXA1、ERG 和 MYC 的核心增強子周圍的染色質,轉錄因子被阻止與驅動癌癥的增強子結合,從而減弱促癌轉錄程序[9]。AU-15330 在前列腺癌異種移植模型中可有效抑制腫瘤生長,并與 AR 拮抗劑 enzalutamide 協同作用(圖10)。